Svelato il comportamento del ‘guardiano del genoma’. Nuove ipotesi terapeutiche nel campo dei tumori
Grazie a una sofisticata tecnica di microscopia, i ricercatori dell’IRCCS Ospedale San Raffaele di Milano hanno potuto osservare dal vivo il comportamento di una proteina antitumorale e ne hanno svelato il meccanismo di attivazione
Milano, 22 agosto 2017 – Ogni volta che il DNA di una cellula viene danneggiato, una proteina chiamata p53, il cosiddetto guardiano del genoma, entra in azione e prende una decisione di drastica importanza: avviare il processo di correzione degli errori del DNA o al contrario quello di autodistruzione della cellula. L’obiettivo è lo stesso: evitare che quest’ultima – accumulando mutazioni nel corso delle generazioni – diventi tumorale.
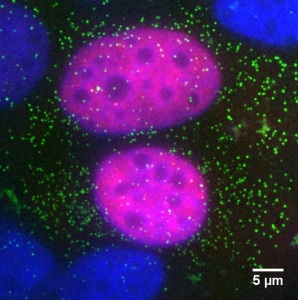
I ricercatori dell’IRCCS Ospedale San Raffaele – una delle 18 strutture di eccellenza del Gruppo Ospedaliero San Donato – hanno osservato per la prima volta in tempo reale la dinamica di p53 nel nucleo cellulare e hanno scoperto che per il successo della sua azione non basta che la proteina sia sana (senza mutazioni) e sia presente in abbondanza, ma è anche necessario che venga attivata da altre proteine. Solo dopo essere stata attivata, p53 è infatti in grado di legarsi al DNA per un tempo sufficiente ad avviare uno dei due processi antitumorali.
Lo studio, pubblicato su Nature Communications, è stato realizzato impiegando una tecnica di microscopia innovativa messa a punto da Davide Mazza, fisico del Centro di Imaging Sperimentale dell’IRCCS Ospedale San Raffaele e membro del Centro Europeo di Nanomedicina, in collaborazione con Carlo Tacchetti, docente presso l’Università Vita-Salute San Raffaele e direttore del Centro di Imaging Sperimentale. La scoperta apre la strada alla messa a punto di nuove strategie terapeutiche basate sull’attivazione di p53.
Le cellule umane possono subire vari tipi di stress in grado di danneggiarne il DNA. Se il danno è limitato, la cellula cerca di porvi rimedio tramite una serie di macchine molecolari il cui compito è ripristinare la corretta sequenza di informazioni del genoma. Se al contrario il danno è troppo per poter essere corretto in sicurezza, la cellula avvia la propria morte programmata, l’apoptosi.
Entrambi i processi fanno capo a un’unica proteina, p53. L’importanza del suo compito le ha fatto guadagnare il soprannome di “guardiano del genoma” e spiega perché più del 70% dei tumori abbia una mutazione nel gene che codifica per lei: il 70% dei tumori, per riuscire a sopravvivere, deve cioè avere una versione difettosa di p53.
Ma che cosa accade nel restante 30%? Perché in questi casi p53, pur non essendo mutata, non riesce a svolgere il suo compito con successo? Per capirlo i ricercatori hanno usato una tecnica di microscopia innovativa che permette di seguire la dinamica di singole molecole all’interno di cellule vive.
La tecnica è stata sviluppata all’Ospedale San Raffaele grazie all’incontro tra Davide Mazza, giovane fisico che ha messo a punto l’apparecchiatura durante un post-doc negli Stati Uniti e il direttore del CIS, Carlo Tacchetti, che ha fornito le competenze biologiche e sperimentali.
“Grazie a questo strumento abbiamo scoperto che l’attivazione di p53 da parte di altre proteine presenti nella cellula è fondamentale: solo se attivata, infatti, p53 è in grado di associarsi al DNA abbastanza a lungo da avviare i processi per cui è programmata e grazie ai quali i tumori hanno vita tanto difficile – spiega Davide Mazza – È come se avesse bisogno che altre proteine accendano per lei un timer d’azione”.
La scoperta ha un ruolo di particolare rilevanza per quei tumori che non presentano una versione mutata di p53, come il neuroblastoma, un tumore del cervello che colpisce soprattutto i bambini. In questi casi il guardiano del genoma potrebbe fallire proprio a causa di una falla nel meccanismo di attivazione scoperto dai ricercatori del San Raffaele.
“La scoperta, oltre a essere rilevante nel campo dei tumori e ad aprire la strada a nuove ipotesi terapeutiche, suggerisce un nuovo modello di funzionamento per ‘i fattori di trascrizione’ – di cui p53 è un esempio – ovvero per tutte quelle proteine che regolano l’espressione di altri geni e quindi sono responsabili dell’avvio di processi cellulari complessi”, conclude Carlo Tacchetti.