Scoperto il ruolo chiave della mielina per contrastare l’invecchiamento cerebrale

Team di ricerca internazionale grazie a nuove tecniche bioinformatiche rivela un ruolo cruciale per la mielina e il recettore GPR17 nell’invecchiamento cerebrale. Allo studio, pubblicato su Aging Cell, ha collaborato il gruppo di ricerca di Maria Pia Abbracchio dell’Università Statale di Milano, che 15 anni fa aveva identificato il recettore GPR17
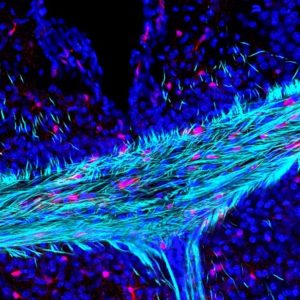
Milano/Padova, 10 marzo 2021 – Uno studio coordinato dal gruppo del prof. Arthur Butt dell’Università di Portsmouth, in collaborazione con l’Università di Padova, l’Università di Dusseldorf e la Statale di Milano ha permesso di ricostruire le cause dell’invecchiamento cerebrale, identificando la mielina come bersaglio primario delle alterazioni associate all’invecchiamento, e ha posto le basi per futuri studi di ‘ringiovanimento’ delle cellule produttrici di mielina.
Lo studio “Functional genomic analyses highlight a shift in Gpr17- regulated cellular processes in oligodendrocyte progenitor cells (OPC) and underlying myelin dysregulation in the aged forebrain” è stato pubblicato in questi giorni sulla prestigiosa rivista Aging Cell.
“Tutti conoscono bene la materia grigia, ma meno apprezzata è la materia bianca, nonostante rappresenti l’altra metà del cervello – spiega il prof. Arthur Butt – La materia bianca è la parte sottostante alla materia grigia ed è composta dagli assoni, i ‘cavi elettrici’ del cervello che connettono le varie parti del cervello. Gli assoni sono ricoperti da una sostanza chiamata mielina, un isolante che in maniera simile alla plastica dei cavi elettrici, ha il compito di isolare gli assoni e quindi facilitare la trasmissione di informazioni attraverso di essi. La mielina è prodotta da cellule cerebrali specializzate chiamate oligodendrociti: una mancanza di mielina ha effetti devastanti sull’attività cerebrale e ne sono esempio le malattie neurodegenerative come la Sclerosi Multipla, l’Alzheimer e la demenza senile”.
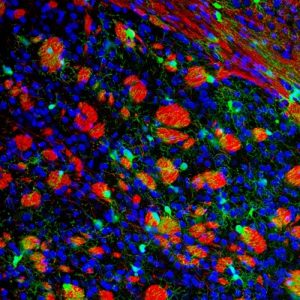
“Nonostante nell’invecchiamento cerebrale si osservi una riduzione della memoria, della capacità di apprendimento e di reazione agli stimoli ambientali, da anni si sa che, nel cervello anziano, il numero dei neuroni, le cellule specializzate nelle funzioni intellettuali e cognitive, non è molto diverso da quello che si osserva nel cervello giovane – spiega la prof.ssa Maria Pia Abbracchio del dipartimento di Scienze Farmaceutiche dell’Università Statale di Milano, coautrice dello studio – Ciò che questo studio mette chiaramente in evidenza è che, nell’anziano, la funzionalità dei neuroni viene alterata a causa di una drastica diminuzione nel numero di oligodendrociti, le cellule specializzate nella produzione di mielina, la sostanza che riveste i prolungamenti nervosi permettendo la trasmissione degli impulsi elettrici e la comunicazione fra le varie parti del cervello e il mondo esterno. La riduzione degli oligodendrociti compromette la capacità di rimielinizzare le zone del cervello dove si verificano danni alla mielina, condizione comune a molte malattie neurodegenerative, in primis la sclerosi multipla”.
“Tramite una tecnica nota come Next Generation RNA Sequencing, che permette di sequenziare grandi genomi in un tempo ristretto, condotta in parallelo sul cervello di topi giovani e anziani e seguita da una complessa analisi di predizioni bioinformatiche, è stato possibile dimostrare che la diminuzione degli oligodendrociti è legata a un progressivo rallentamento di alcune funzioni-base dei loro progenitori “simil-staminali”, gli OPC (oligodendrocyte precursor cells), molto proliferanti e reattivi in caso di danno, che hanno la caratteristica di rimanere vitali durante l’intera vita adulta, provvedendo così a riparare il cervello mantenendone la funzionalità”, conclude Abbracchio.
“Abbiamo comparato il genoma del cervello di topi giovani e anziani di modo da identificare quali processi siano alterati nell’invecchiamento – spiega il dott. Andrea D. Rivera dell’Università di Padova e primo autore dello studio – Queste tecniche di analisi sofisticate ci hanno permesso di dimostrare come la diminuzione degli oligodendrociti nel cervello anziano sia legata a una perdita di cellule staminali cerebrali chiamate Oligodendrociti Precursori. Queste cellule sono essenziali per il ripopolamento degli oligodendrociti e della mielina”.
“Inoltre, abbiamo identificato il gene GPR17 come il gene maggiormente alterato nel cervello anziano. La perdita di GPR17 riduce la capacità degli Oligodendrociti Precursori di ripristinare la materia bianca persa – prosegue Rivera – Abbiamo inoltre usato tecniche bioinformatiche sofisticate per identificare nuovi composti che possano ringiovanire gli Oligodendrociti Precursori e dimostrato che uno di questi, LY-294002, sia in grado di contrastare la perdita di materia bianca causata dal processo di invecchiamento”.
“Studi di fate mapping condotti in parallelo, che permettono di seguire nel tempo il destino finale degli OPC nel cervello, hanno dimostrato che nell’anziano queste cellule mostrano profonde alterazioni del loro metabolismo, della durata del ciclo cellulare e soprattutto della loro capacità di maturare e quindi di produrre mielina” spiega il dott. Davide Lecca, ricercatore che ha collaborato all’analisi bioinformatica dello studio.
“Il gene maggiormente alterato è risultato essere GPR17, recettore identificato 15 anni fa nel nostro laboratorio (Ciana et al., 2006; Lecca et al., 2008) e già implicato in diverse malattie neurodegenerative, inclusa la sclerosi multipla. In particolare, GPR17 è espresso da una sottopopolazione di OPC dotata della capacità di reagire prontamente ad insulti di vario tipo favorendo la rimielinizzazione necessaria al ripristino della funzione cerebrale. La perdita di GPR17 riduce quindi la capacità degli OPC di interagire con l’ambiente circostante e con i neuroni e di rispondere in maniera plastica al danno, compromettendo le attività di connessione sinaptica alla base di processi cognitivi quali memoria e apprendimento” conclude Lecca.
Infine, tramite due distinti approcci di analisi farmacogenomica in silico, i ricercatori hanno anche identificato LY294002 (un inbitore della via di segnalazione intracellulare di mTOR, coinvolta sia nella maturazione degli OPC che nella regolazione di GPR17, Fumagalli et al., 2015) come molecola potenzialmente in grado di revertire alcune delle alterazioni patologiche osservate negli OPC anziani. L’efficacia di questa molecola è stata confermata in un modello in vivo di degenerazione locale della mielina, dove LY294002 ha dimostrato una notevole capacità di rigenerare gli OPC e favorire la rimielinizzazione.
“Ringiovanire” gli OPC potrebbe quindi rappresentare una strategia vincente non soltanto per contrastare l’invecchiamento cerebrale ma anche per migliorare il decorso e favorire la rimielinizzazione nelle malattie neurodegenerative quali sclerosi multipla, ictus cerebrale e Alzheimer.
Lo studio “Functional genomic analyses highlight a shift in Gpr17- regulated cellular processes in oligodendrocyte progenitor cells (OPC) and underlying myelin dysregulation in the aged forebrain” è stato finanziato, fra gli altri, dal MIUR e dalla Fondazione Italiana Sclerosi Multipla (progetto PRIN2017 e FISM-Bandi2017 assegnati alla prof.ssa Maria Pia Abbracchio), dalla Multiple Sclerosis Society UK e dal MSCA Seal of Excellence @ UNIPD.
Fig. 1 – Mielina (azzurro) e speciali cellule staminali cerebrali nel Corpo Calloso
Fig. 2 – Mielina (rosso) e speciali cellule staminali cerebrali chiamate Oligodendrociti Precursori (Verde)






































































