Malattie del neurosviluppo: la maturazione precoce dei neuroni alla base dei deficit cognitivi

Scoperto un nuovo meccanismo associato all’insorgenza di patologie dello sviluppo del cervello (sistema nervoso centrale), dovuto ad un’alterazione nella maturazione dei neuroni durante i primi mesi di vita dei bambini come conseguenza della mutazione del gene OPHN1, associato alla disabilità intellettiva umana. Lo studio, pubblicato su PNAS da un gruppo dell’Istituto di neuroscienze del Cnr, rivela la variazione da cui dipendono i meccanismi molecolari alteranti lo sviluppo neuronale e la possibilità di ripristinare il normale processo di neurogenesi per via farmacologica, identificando nuovi bersagli per le terapie di sindromi come l’autismo

Roma, 2 febbraio 2021 – La comunicazione fra neuroni eccitatori e neuroni inibitori è alla base dell’attività cerebrale. Sempre maggiori evidenze attribuiscono un ruolo chiave ai cosiddetti neuroni inibitori GABAergici, che utilizzano il GABA (acido γ-ammino butirrico), il più comune dei neurotrasmettitori inibitori presenti nel cervello. È stato osservato, infatti, che alterazioni dello sviluppo e/o della funzione dei neuroni inibitori sono alla base di molte patologie dello sviluppo.
Il gruppo di Claudia Lodovichi dell’Istituto di neuroscienze del Consiglio nazionale delle ricerche (Cnr-In) ha pubblicato un lavoro su PNAS-Proceedings of the National Academy of Sciences che dimostra la prima evidenza dell’effetto della precoce maturazione dei neuroni GABAergici sull’insorgenza delle patologie del neurosviluppo, monitorando la migrazione dei precursori neuronali (neuroblasti) attraverso la tecnica di real-time imaging a due fotoni.
Neurobiologa e primo ricercatore al Cnr-In, Claudia Lodovichi ha fatto una lunga esperienza di ricerca negli Stati Uniti, prima alla Duke University di Durham in North Carolina e poi alla Columbia University, New York. Nel 2006, dopo aver vinto il Career Development Award della Fondazione Armenise Harvard, è tornata in Italia, stabilendo il suo laboratorio al Veneto Institute of Molecular Medicine di Padova (VIMM). Ha raggiunto importanti risultati sulla comprensione dei circuiti nervosi generati nel sistema olfattivo.
“La maggior parte dei neuroni inibitori viene generata nel corso della vita embrionale. Tuttavia la neurogenesi persiste anche dopo la nascita lungo le pareti dei ventricoli laterali, nella zona sub-ventricolare (SVZ). I precursori dei neuroni inibitori (neuroblasti) migrano dalla SVZ verso il bulbo olfattivo, l’area cerebrale deputata all’elaborazione delle percezioni olfattive, e verso molte altre aree corticali e sottocorticali, come la corteccia prefrontale, importante per le funzioni cognitive, sociali e di esecuzione – premette Lodovichi – Tale processo è presente nella maggior parte dei mammiferi per tutta la vita, mentre nei bambini si concentra nei primi mesi di vita. Si ritiene che i neuroni inibitori generati in epoca postnatale giochino un ruolo fondamentale nella plasticità neuronale, essenziale per il normale sviluppo del cervello”.
Alterazioni nella migrazione e/o nello sviluppo di questi neuroni potrebbero quindi contribuire all’insorgenza di deficit cognitivi. “Con i miei collaboratori abbiamo studiato nel cervello murino l’impatto della mutazione del gene codificante Oligophrenin 1 (OPHN1), associata a disabilità intellettiva umana, sulla migrazione dei neuroni inibitori generati in epoca post-natale – prosegue la ricercatrice Cnr-In – Aspetti come la minor velocità e l’alterazione della direzionalità di tale migrazione sono associati a specifici deficit neuronali: in particolare, la velocità risulta significativamente ridotta a causa di alterate risposte al GABA, che ha un ruolo sulla regolazione della migrazione dei neuroblasti”.
Gli effetti del GABA sulla migrazione sono opposti nei neuroni di controllo e in quelli mutati e dipendono dalla concentrazione dello ione cloruro (Cl-) intracellulare: “Bloccando con trattamenti farmacologici i complessi KCC2 e con farmaci bloccanti le vie che regolano il rimodellamento dei neuroblasti, siamo riusciti a ripristinarne il normale processo di migrazione e maturazione. Finora molti studi hanno dimostrato che l’alta concentrazione di Cl- intracellulare, associata ad altri fattori, è coinvolta nell’insorgenza di patologie quali le sindromi di Down e Rett e alcune forme di epilessia – conclude Lodovichi – Per la prima volta il nostro studio dimostra che anche il difetto opposto, ovvero che la bassa concentrazione di Cl- dovuta a una prevalenza di complessi KCC2 con conseguente maturazione precoce dei neuroni possa portare allo sviluppo di patologie, in particolare di disabilità intellettiva. Nonostante la complessità della disabilità intellettiva e di patologie come l’autismo, questi studi di ricerca di base sono fondamentali per conoscere i meccanismi neuronali alla loro base e per identificare i bersagli verso i quali indirizzare terapie efficaci”.
Il lavoro, supportato dalla Fondazione Telethon, dalla Fondazione Armenise Harvard e dal progetto NANOMAX del Ministero dell’istruzione, università e della ricerca – Consiglio nazionale delle ricerche, è stato condotto in collaborazione con l’Istituto di nanoscienze del Cnr e il laboratorio National Enterprise for nanoScience and nanoTechnology-Scuola Normale Superiore di Pisa, il Dipartimento di scienze biomediche dell’Università di Padova, Istituto VIMM di Padova, l’Istituto italiano di tecnologia di Genova e l’Istituto Irccs- Università Vita e Salute San Raffaele di Milano.
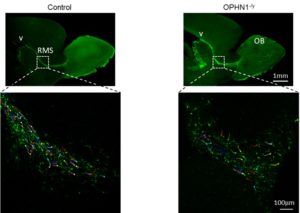
Fig.1 – In alto: sezioni trasversali della parte anteriore del cervello murino con i ventricoli laterali (V), la via di migrazione rostrale (RMS) con i precursori neuronali e il bulbo olfattivo (OB) in animali di controllo (sx) e mutati (dx). In basso: neuroblasti in migrazione, i tratti colorati indicanti il tragitto. Normalmente organizzati in catene di cellule parallele (sx), i neuroblasti nei mutati (dx) sono disposti in maniera caotica e occupano un’area molto più grande