Enzima correlato a tumori e disordini neuropsichiatrici ha un ruolo chiave anche nello sviluppo cerebrale. Scoperta italiana
Lo studio di organoidi cerebrali attraverso le più innovative tecnologie in biomedicina ha permesso di scoprire il ruolo dell’enzima GSK3 nello sviluppo delle nostre funzioni cerebrali. La ricerca IEO-Università Statale di Milano su Stem Cell Reports
Milano, 18 ottobre 2019 – Un gruppo di ricercatori dell’Istituto Europeo di Oncologia e dell’Università degli Studi di Milano, guidati da Giuseppe Testa, Direttore del laboratorio Cellule Staminali e Epigenetica IEO, Professore di Biologia Molecolare all’Università Statale di Milano e Direttore del Centro di Neurogenomica dello Human Technopole, ha scoperto il ruolo dell’enzima GSK3 nelle funzioni specifiche del cervello umano, indagando per la prima volta cosa accade nelle fasi precoci del nostro sviluppo cerebrale, attraverso tecnologie di frontiera, come gli organoidi. Lo studio è appena stato pubblicato su Stem Cell Reports.
“GSK3 è un enzima che, grazie alla sua capacità di ‘accendere’ o ‘spegnere’ l’attività di svariate proteine bersaglio, svolge un ruolo fondamentale nella regolazione di molteplici processi biologici, fra cui quelli che causano i tumori – spiega Testa – La particolarità di questa affascinante proteina è quella di regolare i meccanismi di sopravvivenza e morte delle cellule con modalità complesse e dipendenti dal tipo di cellula. Per saperne di più, siamo quindi andati a indagare un altro processo in cui GSK gioca un ruolo chiave: lo sviluppo dei neuroni che compongono la corteccia cerebrale. Qui, abbiamo scoperto che GSK3 si trova al crocevia dei meccanismi di proliferazione cellulare, che permettono di espandere il numero di cellule progenitrici, e di quelli che determinano la loro trasformazione in neuroni maturi. Le mutazioni a carico del gene che codifica per GSK3 sono infatti associate a diversi disordini neuropsichiatrici, tra i quali autismo, schizofrenia, disordine bipolare e disturbo depressivo maggiore. Ciò che ci ha permesso di investigare eventi così complessi e intrinsecamente legati all’unicità del sistema nervoso umano è stata l’adozione di un innovativo modello sperimentale: gli organoidi cerebrali, o mini-cervelli in provetta”.
“Si tratta di colture cellulari tridimensionali – spiega Alejandro López-Tobón, co-autore dello studio – Partendo da cellule staminali pluripotenti umane, in grado di generare tutte le cellule del nostro organismo, e guidando il loro differenziamento tramite l’utilizzo di un apposito cocktail di molecole, è infatti possibile ottenere strutture che si sviluppano simulando accuratamente l’organizzazione spaziale e temporale di molteplici tipi di cellule che compongono la corteccia cerebrale fetale umana”.
“Durante questo processo di sviluppo – continua Carlo Emanuele Villa – gli organoidi sono stati esposti ad un trattamento cronico con un inibitore selettivo di GSK3 per indagare il suo contributo nei processi chiave che regolano, durante lo sviluppo fetale, l’espansione della corteccia cerebrale. Il trattamento con la molecola inibitrice ha mostrato una profonda alterazione della distribuzione spaziale dei diversi tipi di cellule che si sviluppano negli organoidi, impedendo la formazione delle caratteristiche strutture organizzate di progenitori che supportano i neuroni nella migrazione verso la loro destinazione finale nella corteccia”.
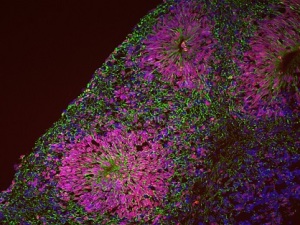
Immagine ad alto ingrandimento acquisita con microscopio ottico in fluorescenza. Sulla sinistra un organoide corticale normale, sulla destra un organoide trattato con inibitore di GSK3. La formazione di strutture spazialmente organizzate, chiamate rosette, con cellule progenitrici (in rosso) al centro e neuroni maturi (in verde) all’esterno di essa, è riscontrata solo in situazione fisiologica, mentre viene persa in seguito al trattamento
La corteccia cerebrale è la parte più esterna del nostro cervello ed è sede di funzioni cognitive complesse, quali il pensiero cosciente. Oltre ad essere la regione cerebrale più recente dal punto di vista evolutivo, è anche quella che, a causa della notevole espansione delle sue dimensioni, più contraddistingue come unico il cervello degli esseri umani quando paragonato ad altri animali.
La ragione per cui nell’uomo si è verificata una massiccia espansione nel numero di neuroni nella corteccia cerebrale risiede nell’evoluzione di un particolare tipo di progenitori neuronali chiamati “outer radial glia”, i quali hanno una capacità di generare nuovi neuroni maggiore rispetto ad altre classi di progenitori. Questo tipo di cellule è però assente nei roditori e il loro studio è stato finora limitato dalla carenza di modelli sperimentali adeguati.
“Per poter scendere nel dettaglio del ruolo che GSK3 gioca all’interno di ogni singolo tipo cellulare – continua Cristina Cheroni – abbiamo fatto ricorso alla trascrittomica a singola cellula (‘single cell sequencing’), la quale permette di misurare le molecole di RNA messaggero (poi ‘tradotte’ in proteine) all’interno di ciascuna cellula. Questa avanzata e innovativa tecnica di biologia molecolare ha rivoluzionato negli ultimi anni il livello di dettaglio con cui complesse ed eterogenee popolazioni cellulari possono essere caratterizzate. Nel nostro studio, i dati di trascrittomica a singola cellula hanno rivelato un effetto specifico di GSK3 sull’‘outer radial glia’, la cui presenza risulta fortemente ridotta in seguito al trattamento con l’inibitore, definendo il ruolo fondamentale di questo enzima nello sviluppo di neuroni maturi attraverso questo cruciale tipo di progenitori. Il nostro studio ha quindi dimostrato che, quando GSK3 viene inibita, il differenziamento neuronale avviene principalmente a partire da precursori più precoci, perdendo così i vantaggi della caratteristica evolutiva più importante della corteccia cerebrale umana.
“Siamo particolarmente soddisfatti perché è la prima volta che gli organoidi cerebrali e l’analisi omica a singola cellula, due delle tecnologie più innovative in biomedicina, vengono combinate non solo per descrivere lo sviluppo della corteccia cerebrale umana ma per definire un meccanismo chiave alla base della sua specificità”, ha concluso Giuseppe Testa.
La ricerca si è avvalsa della collaborazione dei team di ricerca dell’Università degli Studi di Milano guidati da Elena Cattaneo, docente di Farmacologia presso il Dipartimento di Bioscienze, e da Massimiliano Pagani, docente di Biologia Molecolare presso il Dipartimento di Biotecnologie Mediche e Medicina Traslazionale.
Il lavoro è stato realizzato grazie al contributo di Associazione Italiana per la Ricerca sul Cancro (AIRC) ( IG 2014-2018 to G.T.); EPIGEN Flagship Project of the Italian National Research Council (CNR) (to G.T., G.M., and M.P); European Research Council (ERC DISEASEAVATARS no. 616441 to G.T.); Fondazione Cariplo ( 2017-0886 to A.L.-T.); Fondazione Italiana per la Ricerca sul Cancro ( FIRC ); Fondazione Istituto Europeo di Oncologia – Centro Cardiologico Monzino (IEO-CCM) (to P.L.R.); AIRC grant no. IG2016-ID18575 (to M.P.); ERC Consolidator grant no. 617978 (to M.P.); IEO Single Cell Program, EDCMixRisk, ENDPOINTS e Regione Lombardia.